
2025-04-19 23:47 工业建筑
中国医药行业处于“仿制药战略”向“创新药战略”的转型关键期,国家出台多项政策鼓励创新药研发,包括临床试验数据核查、药品上市许可持有人制度、加快创新药审评审批等五大方向,本文将对其进行深度解读。
文章内容节选自《2018中国医药研发创新研究报告》,回复“医药报告”可获取报告全文。
医药,在全球拥有万亿市场,这里诞生了辉瑞、强生、阿斯利康等众多国际制药企业巨头。它们不仅生产药物,而且不断研发首创新药,为攻克人类疑难病症贡献颇多,同时企业获得相当可观的经济回报。中国的医药市场中,同样存在恒瑞、正大天晴、扬子江药业等注重新药研发的制药企业。然而,中国大多数药企以生产仿制药为主,研发意识与投入低,创造新兴事物的能力弱。
2015年以来,国务院、卫计委、食药监局、发改委等多个国家级部门密集发布医药研发有关政策,严格规范新药审批流程,给予创新药诸多优惠政策,以期推动国内药企从“仿制药战略”向“创新药战略”转型。伴随欧美等发达经济体继续限制或削减医疗卫生预算,以及新药研发成本的不断攀升,医药研发的“阵地”开始转向中国、亚太地区及拉丁美洲等其他几个国家和地区。我们大家可以预见,中国将迎来医药研发创新的黄金时期。
总体来看,政策主要从五个方向推进以创新力为核心的医药研发进程,可概括为五大关键词:临床试验数据核查,药品上市许可持有人制度,加快创新药审评审批,鼓励优质创新药品与国际接轨,配套政策提质量、促创新。

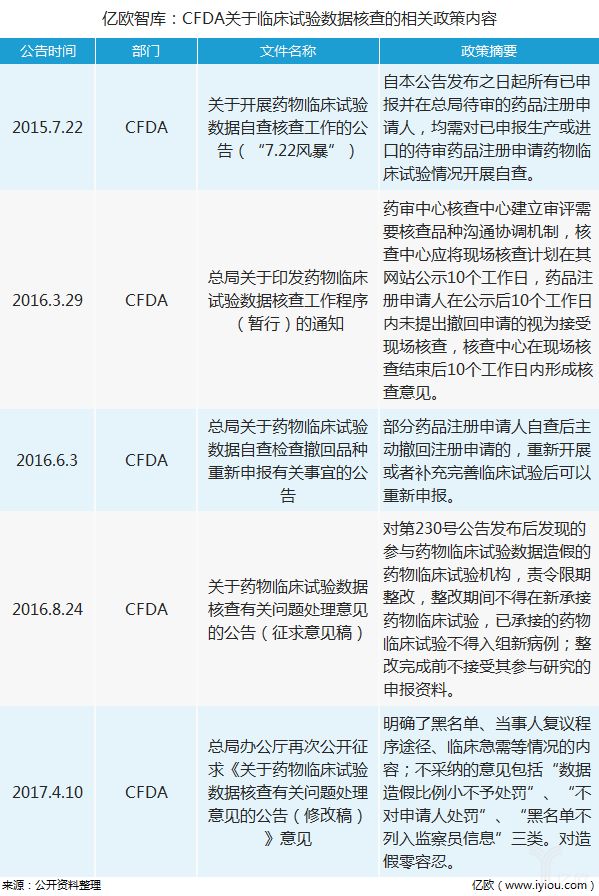
2015年起,CFDA在国内医药行业掀起了临床试验数据核查“风暴”,严惩故意造假,允许规范补正,从而正式拉开了新药研发的改革序幕。此次核查中,超过七成的申报药物被撤回,暴露出来的问题也充分说明国内药企研发投入意识不足,中国研发投入只有全球研发投入的5%左右,仅辉瑞一家公司的研发投入就等于国内全国医药企业的研发投入还多。
自此次核查“风暴”以来,药企更看重临床试验的品质,促使其选择更优质的CRO企业,同时也促进了国内CRO企业提升临床试验水平,价格战局面得到扭转。

我国正在经历药品注册制度改革,即从上市许可与生产许可“捆绑制”,向药品上市许可持有人制度转变。过去所实行的“捆绑制”存在诸多弊端,包括:
第一,药品研发动力不足。由于上市许可和生产许可捆绑在一起,为把研发成果转化为可使用的医药产品,研发者或投资建厂,因此导致成本增大,无力再从事其他新药研究;或追求短期利益,进行技术转让,从而不再关心药品的进一步改善和完善;更不可思议的是一些研发者采用“暗箱操作”的手法私下多次转让、分段转让或“重复研发”,导致药品研发低水平重复和创新乏力等一系列问题。
第二,行业资源配置效率低下。生产企业为追求市场效益,逐步扩大药剂生产的品种或建设新的生产线,从而造成药品生产重复建设和生产设备闲置率过高的虚假“繁荣”;更有少数企业以剂型、包装、规格等不同为由重复申报批准文号,造成上市许可泛滥和空置,影响我国制药行业的良性有序发展和创新。
第三,相关主体权责不清。现行许可制度并未清晰界定药品生产者、经营者和医疗机构等相关主体的法律责任,导致其各管一段,没有对药品质量在其整个生命周期始终负担全责的主体。尤其是现行制度没有明确规定研发者的法律责任,导致研发者以技术转让为由将质量责任转移至生产企业,从而使药品质量无法自始至终地得到一致性保障,更无法有效地形成上市后药品不良反应的监控和改进。
第四,政府行政资源浪费。“捆绑”监管虽然曾经起到了严格监管的作用,但由于该制度内在的不足,导致监管部门把大量资源浪费在低水平重复申报的审评审批上,没办法形成有效的药品全生命周期的监管,无力推动药品产业创新,也难以建立科学、有效的药品监管体制。
2015年8月,在《国务院关于改革药品医疗器械审评审批制度的意见》之中,提出“开展药品上市许可持有人制度试点,落实申请人申报主体责任”。2017年10月,国家食品药品监管总局办公厅公开征求《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》意见,其中一条为“全方面实施药品上市许可持有人制度”。
药品上市许可和生产许可分离的管理模式有助于研发者获得和集中资金、技术和人力进行持续研究和新药研发,有助于明确和强化研发者在药品研发、生产、流通和使用的整个周期中承担对应的法律责任,促使其一直在改进和完善技术,保障药品安全,提高药品质量。

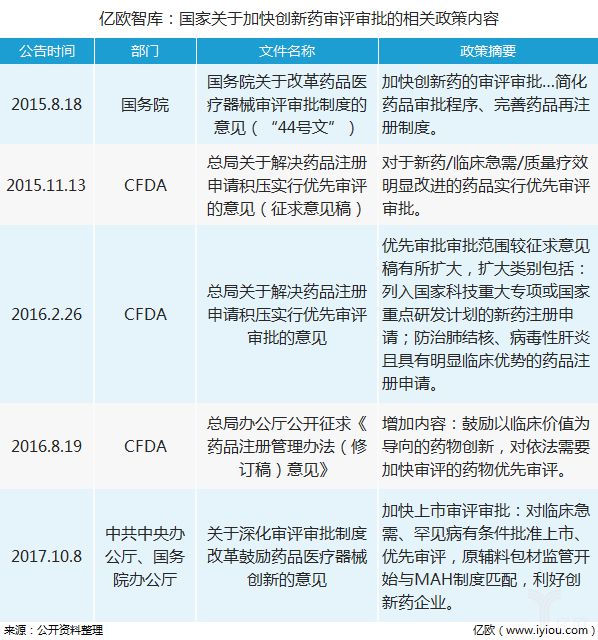
2015-2017年,多项国家政策文件中提出,要加快创新药审评审批,以缩短审评审批流程。加快临床急需等创新药械上市步伐,一批新药优先获准上市。该政策被认为是“建国以来医药行业的最重大政策”,其对于激发医药研发的活力,提高我们国家医药产业的创新发展水平,解决临床急需药品短缺难题具备极其重大的意义。
在该政策推动下,江苏恒瑞医药股份有限公司申报的新药“马来酸吡咯替尼”,因有着非常明显临床优势被总局药审中心纳入优先审评名单。据不完全统计,2016-2017年,已先后有23批近300个药品注册申请进入优先审评程序。

以临床价值为导向的药物研发,是国家重点鼓励的方向。具体而言,国家出台了专利保护、临床试验数据保护、国家工作人员保密责任、规范学术推广行为、支持中药传承和创新等多项内容。
2017年6月,CFDA正式加入ICH(International Council for Harmonization,人用药品注册技术要求国际协调会议),标志着国际社会对中国政府药品审评审批改革和中国医药产业的认可,有利于中国医药行业在研发、监管等各方面与国际接轨。同时,这将推动国际创新药品早日进入中国市场,满足临床用药需求,同时提升国内制药产业创造新兴事物的能力和国际竞争力。

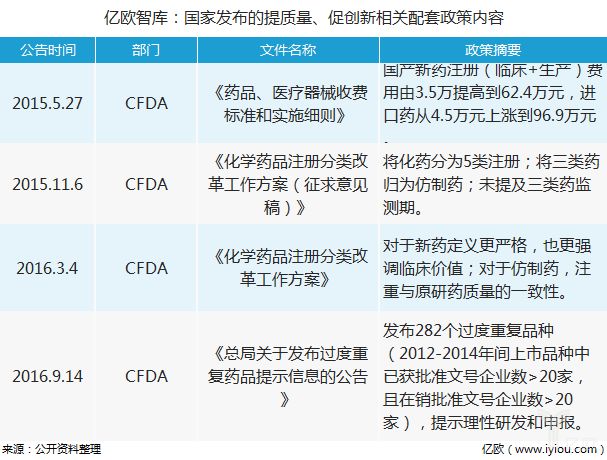
除了上述政策外,国家食品药品监督总局还出台了一系列配套政策,以提升研发药物的质量,促进新药研发。这中间还包括对国产新药注册费用的提升,化学药品注册分类的修订,以及发布过度重复药品的提示信息,以规范药企研发价值导向。
例如,2015年国产新药注册(临床+生产)费用由3.5万提高到62.4万元,进口药从4.5万元上涨到96.9万元:药品注册收费标准的大幅度的提高,一种原因是与国际接轨迈出第一步(调整后的收费标准,仅相当于澳大利亚的64%,加拿大的35.5%,美国的5.2%和日本的33.7%),另一方面对于整治仿制药产能严重超过标准的国内现状,提高仿制药整体水平有着积极的作用。
以上是亿欧智库通过五个关键词,对2015-2017年间国家发布的一系列医药研发有关政策的解读。该内容节选自《2018中国医药研发创新研究报告》,了解更多详细的内容欢迎